Buenas tardes, profe Miriam!
En esta oportunidad quisiera consultarle unas dudas que tengo sobre equilibrio conformacional. Voy a enumerarlas, para tratar de ser lo más clara posible:
1- Tengo entendido que las conformaciones que presentan una mayor estabilidad son las denominadas anti, donde las nubes electrónicas de los grupos más voluminosos no experimenten repulsión. Mi duda es, si tuviese que indicar cuáles son los confórmeros estables de una molécula, ¿estarían allí incluidas además las conformaciones alternadas gauche?
2- En el caso de tener una conformación eclipsada, donde se estuvieran repeliendo fuertemente los grupos más voluminosos, y, por lo tanto, sería necesario rotarla, para así liberar tensión estérica. Al realizar esa rotación, ¿se entrega energía a la molécula?
3- ¿De qué manera obtienen energía las moléculas para pasar de una conformación a otra?
4- ¿El concepto de barrera energética hace referencia a la suma de energía que poseen los enlaces de una molécula?
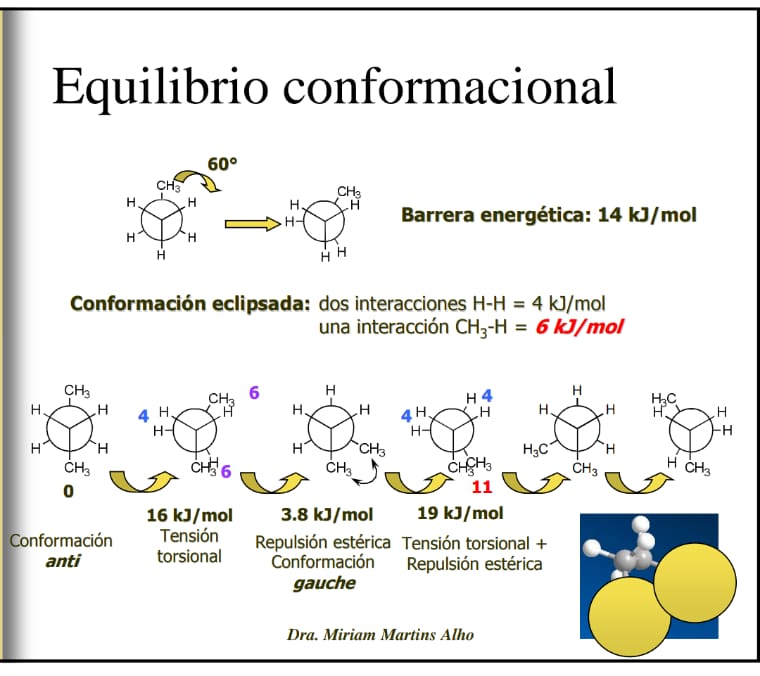
5- (y última!) En la diapositiva que dejo a continuación, en el cambio de estadío de la conformación eclipsada a la conformación gauche, ¿la barrera energética disminuye tanto porque los hidrógenos están lo suficientemente alejados de manera tal que ya no interaccionan entre sí?
Espero que pueda responderme, y perdón por la extensión de mi mensaje.
Gracias y saludos!
Bianca
Hola Bianca, buenos días:
Voy a tratar de ir respondiendo tus dudas de a una.
1- Tengo entendido que las conformaciones que presentan una mayor estabilidad son las denominadas anti, donde las nubes electrónicas de los grupos más voluminosos no experimenten repulsión. Mi duda es, si tuviese que indicar cuáles son los confórmeros estables de una molécula, ¿estarían allí incluidas además las conformaciones alternadas gauche? Buena pregunta. En el caso de una molécula abierta (es decir, que no forma ciclos y por lo tanto, no está tan tensionada), existe una libertad conformacional mayor, y teniendo en cuenta que las barreras energéticas entre una conformación y otra son relativamente bajas, la misma temperatura ambiente suele ser fuente de energía para que se pase de una conformación a otra. Dicho de otra manera: si pudieras ver todas las moléculas la mismo tiempo, verías que una mayoría está en su conformación anti (lo que para una cadena, denominamos conformación zig-zag-planar extendida), pero también vas a encontrar muchas moléculas (aunque en menor número que las anti) en su conformación gauche y hasta (en menor número) formas eclipsadas. A dónde quiero llegar: si te preguntamos por la conformación de mínima energía, es la de mínima energía y punto, es decir, la anti. No obstante, tenés que saber que no hay tanta diferencia con las otras, así que van a coexistir, no es que por ser la menos energética sea la conformación excluyente, siempre es un equilibrio. De hecho, y esto como dato extra, existen alguna sustituciones que benefician rotaciones de la cadena para evitar las interacciones 1,3- que se darían en una conformación zig-zag y predomina la conformación gauche en lugar de a anti, pero esas son cosas que normalmente no vemos en la materia, sólo les tomamos las generalidades.
2- En el caso de tener una conformación eclipsada, donde se estuvieran repeliendo fuertemente los grupos más voluminosos, y, por lo tanto, sería necesario rotarla, para así liberar tensión estérica. Al realizar esa rotación, ¿se entrega energía a la molécula? Si, como te dije antes, para pasar de una conformación a otra es necesario superar una barrera y para ello se necesita energía, lo que ocurre que esa energía normalmente es muy baja y se obtiene de la misma temperatura del medio ambiente.
3- ¿De qué manera obtienen energía las moléculas para pasar de una conformación a otra? Contestada más arriba
4- ¿El concepto de barrera energética hace referencia a la suma de energía que poseen los enlaces de una molécula? La barrera energética está directamente relacionada con las interacciones que hay que vencer para pasar de una conformación a otra. En cada conformación particular hay interacciones entre los enlaces y los sustituyentes. En general, en una conformación alternada hay menos interacciones porque no existe repulsión electrónica entre los enlaces, tan sólo interacciones entre los sustituyentes cuando están en posición relativa gauche. Cuando eclipsás para pasar de una alternada a otra, a las repulsiones estéricas por eclipsamiento se suman las interacciones de los electrones de las uniones, por lo tanto, para poder efectuar ese giro, tenemos que tener una sumatoria de energía igual o mayor a todas las que se contabilizan por los diversos factores, pero no influye la "energía" del enlace en sí (que tiene que ver con el grado de superposición orbital).
5- (y última!) En la diapositiva que dejo a continuación, en el cambio de estadío de la conformación eclipsada a la conformación gauche, ¿la barrera energética disminuye tanto porque los hidrógenos están lo suficientemente alejados de manera tal que ya no interaccionan entre sí? Algo por el estilo. La energía de una conformación alternada donde todos son H se considera 0, es decir que se toma como base para contabilizar el incremento energético de cada interacción en particular, y se considera 0 porque precisamente, los H son tan pequeños que no ejercen ningún tipo de interacción estérica. En esa conformación gauche, la única interacción que existe es la de los metilos, grupos considerablemente más voluminosos.
Espero que esto te sirva, y si no, volvé a escribirme. No te preocupes por la "longitud" o extensión de tu mail, cuando empezamos a estudiar QO normalmente lo único que tenemos es dudas!!
Saludos
Miriam
Buenos días, profe. Quedó muy claro! Muchas gracias por su respuesta. Saludos!
